Bula com lupa: até quando?
 “Novas” regras facilitam a leitura e a compreensão do “manual de instruções” dos medicamentos. Porém, poucas marcas estão cumprindo a norma aprovada há três anos
“Novas” regras facilitam a leitura e a compreensão do “manual de instruções” dos medicamentos. Porém, poucas marcas estão cumprindo a norma aprovada há três anos
Ler a bula antes de tomar qualquer medicamento é fundamental. Mas essa precaução nem sempre é fácil. O metalúrgico aposentado Dirceu Rodrigues, 53 anos, de Campo Limpo Paulista (SP), costuma ter muita dificuldade para enxergar as letrinhas pequenas das bulas, mesmo usando óculos. “Uma vez, o médico me receitou um remédio para dor na perna, mas não explicou como deveria tomá-lo. Tentei procurar na bula, mas não consegui. Era muito miudinha [a letra]”, conta Rodrigues, que precisou voltar à farmácia e pedir orientação a um farmacêutico. O aposentado não passaria por tal situação se os medicamentos seguissem as regras para bulas estabelecidas pela Resolução da Diretoria Colegiada (RDC) no 47 da Agência Nacional de Vigilância Sanitária (Anvisa), aprovada em 2009 e republicada em 2010. Entre as principais mudanças está a adoção de letras maiores para garantir a legibilidade: fonte Times New Roman tamanho 10.
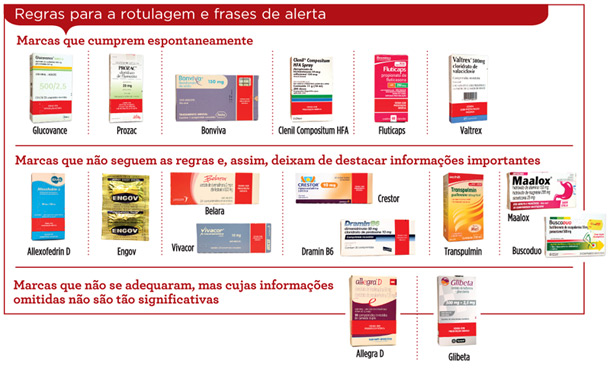
No entanto, três anos depois, poucos remédios estão adaptados à norma. O Idec avaliou 17 medicamentos alopáticos cuja comercialização com a nova bula já é obrigatória, mas apenas cinco deles estão em total conformidade com a RDC no 47. Do restante, três apresentam bulas no formato antigo, totalmente irregular, e os outros nove, embora tenham adotado o novo padrão, não cumprem todas as regras estabelecidas. “Alguns omitem alertas importantes de contraindicação do produto, o que pode colocar em risco a saúde do usuário. Em outros, as falhas são menos graves – ou seja, embora descumpram a norma, as informações omitidas não representam perigo para o consumidor”, aponta Carlos Thadeu de Oliveira, gerente técnico do Idec. Veja na página 30 o resultado de todos os medicamentos analisados.
Para José Vílmore, diretor do Conselho Federal de Farmácia (CFF), a implementação das novas regras deve contribuir para que as pessoas, finalmente, criem o hábito de ler a bula antes de iniciar o tratamento. “Em muitos casos, o paciente não lê porque tem a falsa impressão de que o medicamento é totalmente seguro. Mas todo remédio oferece riscos e, por isso, a bula deve indicar detalhadamente a forma correta de utilizá-lo: qual a dosagem, o que fazer em caso de esquecimento, efeitos colaterais ou reações adversas”, destaca Vílmore.
Com o objetivo de avaliar se os medicamentos disponíveis no mercado seguem as regras para bulas aprovadas em 2009 (RDC nº 47), o Idec consultou no Bulário Eletrônico da Agência Nacional de Vigilância Sanitária (Anvisa) – www.anvisa.gov.br/bularioeletronico – quais remédios já têm a nova bula aprovada e publicada.
Depois, em janeiro, comprou 19 desses produtos: Allegra D, Allexofedrin D, Belara, Bonviva, Buscoduo, Clenil Compositum HFA, Crestor, Dicloridrato de levocetirizina, Dramin B6, Engov, Flutcaps, Glibeta, Glucovance, Maalox, Prozac, Transpulmin, Valtex, Vivacor e Zyxem. Porém, os antialérgicos Zyxem e Dicloridrato de levocetirizina não foram avaliados, pois a data divulgada pela Anvisa no Bulário Eletrônico estava errada e, por isso, os remédios adquiridos pelo Idec não precisavam estar adequados à norma. Todos os demais foram fabricados depois do prazo de 180 dias da publicação no Bulário Eletrônico, o que significa que já devem, obrigatoriamente, apresentar a bula em conformidade com a RDC nº 47/2009. Além das bulas, o Idec analisou as informações disponíveis nas embalagens e a inclusão de frases de alerta sobre riscos associados aos medicamentos.
Esta pesquisa foi apoiada pelo Fundo de Direitos Difusos (FDD), do Ministério da Justiça.
ORIENTAÇÃO ADEQUADA
Não é só do tamanho da letra que a RDC no 47 trata. Ela aborda uma série de outros pontos importantes, como a obrigatoriedade de a bula fornecer orientações ao paciente, em formato de perguntas e respostas, e linguagem de fácil compreensão. “Antes, as bulas traziam informações para o usuário e para o profissional de saúde. Era muito conteúdo, por isso a letra era tão pequena. Além disso, como muitas vezes a informação para o paciente era apenas uma cópia da dirigida ao profissional, a linguagem era muito técnica, o que dificultava a compreensão”, explica Mirtes Peinado, biomédica sanitarista do Programa Estadual de Farmacovigilância da Secretaria da Saúde do Estado de São Paulo.
Não entender direito as instruções da bula pode ser muito perigoso. A aposentada Maria Cecília Martins Aquino, 66, de São Paulo (SP), sabe bem disso. Há alguns meses, ela confundiu a dosagem do xarope que seu neto, de apenas seis meses, estava tomando: em vez de dar 7 mL, como recomendado, ela deu sete gotas. Como a quantidade foi abaixo do ideal, o remédio não fez efeito e a criança teve febre de 39,7º C. “Foi um susto. Somente quando minha filha chegou em casa é que percebemos o equívoco. A bula era muito confusa, tinha informações sobre a dosagem do xarope, de drágeas e de gotas”, lembra a aposentada.
Felizmente, no caso do neto de Maria Cecília o erro não provocou consequências tão graves. Mas o uso incorreto ou abusivo de medicamentos é a principal causa de intoxicação no país, de acordo com dados da Fundação Oswaldo Cruz (Fiocruz): 24% dos registros. Como todo remédio traz riscos, a bula é uma fonte importante de informação para se evitar acidentes. “É essencial que os dados nela contidos sejam completos, exatos e, principalmente, compreensíveis. A omissão e a imprecisão de informações na bula e na embalagem dos remédios podem pôr em risco a saúde e até a própria vida do consumidor”, destaca Mirtes.
Contrariando a sua função de orientar, a bula de dois medicamentos analisados pelo Idec, o Crestor e o Vivacor (ambos utilizados para o controle do colesterol e fabricados pela mesma empresa farmacêutica, a Astrazeneca), trazem informações incorretas sobre os produtos: indica que podem ser usados por adultos e crianças maiores de 10 anos, enquanto a versão aprovada pela Anvisa e publicada no Bulário Eletrônico registra apenas o uso adulto. No caso do Vivacor, apenas a versão eletrônica da bula informa que o medicamento não é indicado para crianças, pois não foi estabelecida segurança e eficácia para esse grupo. Falha gravíssima!
A NORMA EMPACOU
Antes de selecionar os medicamentos para avaliação, o Idec consultou o Bulário Eletrônico da Anvisa, em que são publicadas as informações de todos os medicamentos autorizados no país, e constatou que há apenas 313 bulas de acordo com a RDC no 47. Dessas, boa parte pertence a produtos fitoterápicos e homeopáticos, e somente 94 a remédios alopáticos. “É um número insignificante se comparado ao total de medicamentos registrados no país, estimado em 14 mil”, destaca Oliveira, do Idec.
Segundo a norma, antes de o medicamento ser comercializado com a nova bula, ele deve passar pela avaliação da Anvisa. Ou seja, não depende somente do fabricante, mas também da capacidade de a agência reguladora analisar as informações e publicá-las. Depois de a versão atualizada ser divulgada no Bulário Eletrônico, a empresa ainda tem 180 dias para acabar com o estoque antigo e passar a fabricar os produtos com a bula de acordo com as novas regras.
A expectativa inicial da agência era de que todos os medicamentos estivessem adaptados até o fim de 2012, o que não aconteceu. “Acompanho os jornais e faz tempo que ouço falar que as bulas vão ter letras maiores, mas, até agora, nada”, lamenta o aposentado Rodrigues. “A nova resolução sobre bulas é um grande avanço. O problema é que ela está demorando demais para ser implementada”, critica Mirtes Peinado. A Revista do Idec perguntou à Anvisa o porquê de tanto atraso, mas a agência não respondeu até o fechamento desta edição.
Em 2008, o Idec avaliou as bulas de 19 medicamentos e verificou que elas não faziam alertas importantes e tinham dados confusos. Com base nos péssimos resultados, o Idec enviou suas contribuições à consulta pública que resultou na RDC no 47/2009. A resolução saiu, só falta ser colocada em prática.
O Idec comunicou o resultado da pesquisa à Anvisa e às 16 empresas que fabricam os medicamentos avaliados. A agência reguladora e quatro farmacêuticas — Astrazeneca, E.M.S, Eli Lilly e Roche — não se manifestaram até o fechamento desta edição. Vale lembrar que os medicamentos da Eli Lilly e da Roche não apresentaram inadequação.
De forma geral, a maioria das empresas alegou não considerar suas bulas inadequadas, uma vez que elas foram “aprovadas pela Anvisa”. Boa parte das farmacêuticas também declarou não seguir as regras de rotulagem porque o prazo para adequação estabelecido pela RDC nº 71/2009 foi suspenso; algumas, inclusive, alegaram que, por essa razão, “não é necessário informar” os itens que o Idec apontou.
Apenas três empresas — Glaxo Smith Kline (GSK), Janssen Cilag e Torrent — reconheceram todas as inadequações identificadas pelo Idec e informaram que estão adotando medidas para sua correção.
A Chiesi e a Eurofarma, responsáveis pelos medicamentos Zyxem e por seu genérico, Dicloridrato de levocetirizina, respectivamente, responderam que houve falha da Anvisa ao divulgar no Bulário Eletrônico a data de aprovação da nova bula desses medicamentos. A data correta seria 27/04/2012 e não 18/04/2011. Dessa forma, somente os medicamentos fabricados a partir de 27/10/2012 foram colocados no mercado com a nova bula.
Aprova e depois suspende
Em 2009, além das novas regras para bulas, a Anvisa aprovou a RDC no 71/2009 com diretrizes para o rótulo das embalagens de medicamentos (tanto a interna – frasco, blister etc. –, quanto a externa – caixa, por exemplo). Veja as principais novidades desse regulamento na página 31.
O prazo estipulado para a adaptação das empresas a essas regras era de 540 dias, que se encerraria em 22 de junho de 2011. No entanto, alguns dias antes dessa data, a Anvisa suspendeu o prazo. “Embora a resolução esteja em vigor (somente o período para adaptação foi suspenso), a Anvisa deixa a critério das empresas segui-la ou não”, aponta Oliveira, gerente técnico do Idec.
Outra importante resolução foi aprovada e depois “descartada” pela Anvisa: a RDC no 60/2010, que estabelece a inclusão de frases de alerta nas bulas e nos rótulos para dar destaque a advertências, precauções e contraindicações importantes, como risco de uso do medicamento durante a gravidez e a amamentação, por exemplo. Um dia depois de a norma entrar em vigor, em dezembro de 2010, a Anvisa a suspendeu sem nenhuma explicação. Assim, permanece em vigor a RDC no 137/2003, que trata do mesmo assunto, porém é muito menos abrangente.
Mesmo com os regulamentos suspensos, o Idec verificou que seis das 17 marcas de medicamentos avaliadas já se adequaram às exigências. Oliveira ressalta que o direito à informação garantido pelo artigo 6o do Código de Defesa do Consumidor (CDC) já seria suficiente para que as empresas declarassem os riscos da forma mais abrangente possível, mas avalia positivamente a antecipação dessas marcas às regras que, cedo ou tarde, devem entrar em vigor. “Essas normas já passaram por consulta pública e foram consolidadas pela Anvisa. O fato de estarem suspensas não reverte isso”, ele aponta. Para Mirtes Peinado, a adoção “voluntária” das frases de alerta é uma forma de as empresas se protegerem. “A lei deixa claro que os riscos não podem ser omitidos. Se ocorrer qualquer problema, a empresa poderá ser responsabilizada”, diz a biomédica.
O Idec também questionou a Anvisa sobre a suspensão do prazo do regulamento de rotulagem e das novas regras para frases de alerta, mas a agência não se manifestou até o fechamento desta edição.